La magnitud de la capacidad de un átomo para atraer un electrón se denomina electronegatividad.
En una molécula los átomos pueden compartir los electrones de forma equitativa o no.
Cuando
dos átomos poseen igual o similar electronegatividad, comparten los
electrones de manera equitativa (ejemplo: enlaces C-C y enlaces C-H).
Este enlace es denominado enlace no polar. Sin embargo, la mayoría de
los átomos poseen distinta electronegatividad, formando enlaces polares.
En los enlaces polares los electrones no se comparten por igual. Los
electrones se encuentran más atraído por el átomo más electronegativo,
de manera que se genera una densidad de carga negativa δ- en el átomo más electronegativo y una
densidad de carga positiva δ+ en el átomo menos
electronegativo (ejemplo: enlace O-H). Esto es característico de los
enlaces polares.
Esta diferencia de cargas en la
molécula es muy importante para describir la solubilidad de distintos
compuestos. Como regla general, decimos que las sustancias polares son
solubles en solventes polares mientras que las sustancias no polares son
solubles en solventes no polares.
Una molécula polar
posee una porción con densidad de carga negativa donde se encuentra el
átomo más electronegativo, y una porción con densidad de carga positiva.
De forma tal que cuando se juntan dos moléculas polares, las porciones
con densidad de carga positiva de una molécula será atraída por la
porción con densidad de carga negativa de la otra. De esta manera se
explica la solubilidad de compuestos polares en solventes polares: hay
una interacción de las densidades de carga de las moléculas.
Un
ejemplo muy importante de solvente polar es el agua. Una molécula de
agua está formada por un átomo de oxígeno unido a dos átomos de
hidrógeno. El oxígeno es muy electronegativo respecto al hidrógeno, por
lo tanto, los electrones que forman el enlace covalente entre los átomos
de oxígeno e hidrógeno generan una densidad de carga negativa sobre el
átomo de oxígeno y una densidad de carga positiva sobre los átomos de
hidrógeno. Por lo tanto, el enlace O-H posee un dipolo eléctrico.
La creación de dipolos eléctricos en los enlaces covalentes posibilita interacciones electrostáticas no covalentes entre moléculas. (Ejemplo: puentes de hidrógeno)
Entonces,
las sustancias solubles en solventes polares son solubles en agua, por
lo tanto se las denomina hidrófilas. Las sustancias no polares son
insolubles en agua, y se las denomina hidrófobas.
La
presencia de los dipolos eléctricos en el agua, no sólo posibilita la
disolución de compuestos polares, sino también la organización de la
arquitectura de las moléculas de agua.
Contacto.
Contacto: propanona@zoho.com
Libros en Instagram: @propanonablog
El contenido de este blog no cuenta con el control ni la corrección de ninguna institución educativa, pública o privada. Las publicaciones de este blog son hechas de manera independiente por el autor del mismo. El autor de desliga de toda responsabilidad por posibles consecuencias derivadas del uso de los contenidos de este blog.
Muchas gracias por su visita, por favor, comentar si encuentra links caídos, los mismos serán resubidos a la brevedad.
También pueden escribir un e-mail a propanona@zoho.com
sábado, 7 de diciembre de 2013
Fundamentos químicos: el átomo de carbono.
El átomo de carbono (C) forma enlaces covalentes estableciendo una estructura tetraédrica. El átomo de C puede unirse un mismo tipo de átomo, como por ejemplo en el metano, donde se encuentra unido a 4 hidrógenos mediante enlaces covalentes formando una estructura tetraédrica formando ángulos de 109,5°. Puede unirse a átomos como por ejemplo el oxígeno (O) con el cual puede compartir dos pares de electrones, formando un doble enlace, de forma tal que la geometría es plana, con ángulos de 120°.
Una particularidad importante que presenta el átomo de carbono tetraédrico es la posibilidad de unirse a cuatro restos diferentes constituyendo una molécula asimétrica (a diferencia de lo que ocurre con el metano). La importancia de estos carbonos asimétricos radica en la capacidad de establecer estereoisómeros (imágenes especulares). Estos estereoisómeros tienen mucha importancia en cuanto a su diferente actividad biológica; incluso uno de esos estereoisómeros puede ser activo desde el punto de vista biológico y el otro puede no tener actividad.
La presencia de átomos de carbono asimétricos determina la obtención de estereoisómeros con diferente actividad biológica.
Esto se da fundamentalmente en las proteínas.
Las proteínas están formadas por aminoácidos, los cuales están formados por un Cα que se encuentra unido a un H, un grupo NH3 , un grupo COOH y un resto R (en la glicina, Gly, el grupo R es un H, por lo tanto no presenta estereoisomería). Como consecuencia de esto, el Cα es un C asimétrico, presentando dos isómeros diferentes: el isómero D y el isómero L, ambos poseen diferente actividad biológica.
Publicado por
Romy Pech
en
11:48
2 comentarios:

Enviar por correo electrónicoEscribe un blogCompartir con TwitterCompartir con FacebookCompartir en Pinterest
Etiquetas:
Biología
Fundamentos químicos: Enlaces químicos e interacciones intermoleculares.
Los enlaces atómicos e interacciones moleculares son las fuerzas de atracción interatómicos que posibilitan la constitución de las moléculas individuales y permiten la interacción entre diferentes moléculas.
Cuando dos átomos comparten un par de electrones (enlace simple) o múltiples pares de electrones (enlace doble, triple, etc) se forman los enlaces covalentes, los cuales son enlaces fuertes. Los átomos comparten electrones para conformar una molécula mediante la formación de enlaces covalentes.
A su vez, estas moléculas pueden interactuar con otras moléculas de igual o distinta naturaleza mediante enlaces no covalentes, los cuales son fuerzas de atracción débiles, pero igualmente importantes para determinar las propiedades y las funciones de las moléculas biológicas como las proteínas, los ácidos nucleicos, los hidratos de carbono y los lípidos.
Dentro de los enlaces no covalentes nos encontramos con
- interacciones iónicas.
- enlaces o puentes de hidrógeno.
- interacciones de van der Waals.
- efecto hidrófobo.
En esta imagen podemos ver una molécula de ADN, vemos la α-hélice del ADN en rosa, y rodeando a la molécula vemos una estructura macromolecular formada por varias subunidades que constituyen la ARN polimerasa que interactúa específicamente con esa molécula de ADN. Tanto la estabilidad y la conformación de la α-hélice como la interacción entre las distintas subunidades que forman la ARN polimerasa, así como también la interacción de la ARN polimerasa con el ácido nucleico (la α-hélice del ADN) se da a partir de estos enlaces no covalentes.
Elementos más abundantes en las moléculas biológicas.
Dentro de los elementos más abundantes en las moléculas biológicas los que prevalecen son: H, C, N y O; también encontramos P y S en menor proporción. Estos átomos establecen entre sí enlaces covalentes (es decir, comparten sus electrones) para conformar las distintas moléculas biológicas (moléculas que van a posibilitar la actividad y la arquitectura celular).
Cada tipo de átomo forma un número característico de enlaces covalentes con otros átomos, con una geometría bien definida, determinada por el tamaño del átomo y tanto por la distribución de los electrones alrededor del núcleo como por el número de electrones que puede compartir.
No todos forman el mismo número de enlaces covalentes ni se disponen de la misma manera en el espacio; entonces tenemos átomos como el H que puede formar sólo un enlace covalente o átomos más complejos desde el punto de vista estructural como el C que puede formar 4 enlaces covalentes con una geometría tetraédrica. Otros átomos como el N y el S pueden formar un número de enlaces covalentes variable, por ende la geometría también es diferente.
Publicado por
Romy Pech
en
11:45
No hay comentarios:

Enviar por correo electrónicoEscribe un blogCompartir con TwitterCompartir con FacebookCompartir en Pinterest
Etiquetas:
Biología
miércoles, 27 de noviembre de 2013
Densidad de gases ideales.
La densidad (δ) es la masa de una sustancia dividida entre su volumen:
donde:
δ= densidad
m= masa
V= volumen
Densidad de gases ideales.
Cálculos de densidad.
Si se reacomoda la ecuación del gas ideal, se puede calcular la densidad de un gas.
El número de moles del gas, n, está dado por:
donde m es la masa en gramos y M es la masa molar. Por tanto:
Dado que la densidad, δ, es la masa por unidad de volumen, se puede escribir:
A diferencia de las moléculas de la materia condensada (es decir, líquidos y sólidos), las moléculas gaseosas están separadas por distancias que son grandes en comparación con su tamaño. En consecuencia, la densidad de los gases es muy bajas en condiciones atmosféricas normales. Por ello, la densidad de los gases se expresa comúnmente en gramos por litro (g/L) en lugar de gramos por mililitro (g/mL)
Problema: Calcule la densidad del amoníaco (NH3) en gramos por litros (g/L) a 752 mmHg y 55°C.
Resolución:
Para convertir la presión a atm, se escribe:
Usando la ecuación y T= (273+55)K= 328K, se tiene:
Nota: la densidad del gas expresada en g/mL sería: 0,000626, un valor muy pequeño.
Publicado por
Romy Pech
en
18:06
No hay comentarios:

Enviar por correo electrónicoEscribe un blogCompartir con TwitterCompartir con FacebookCompartir en Pinterest
Etiquetas:
Química Inorgánica
lunes, 25 de noviembre de 2013
Moléculas.
Una molécula es una asociación de átomos, eléctricamente neutra, que forma una estructura estable.
Unidad de masa atómica (UMA)
u= UMA
Masa atómica promedio.
Se da en UMA.
.gif) unidades/mol (Constante de Avogadro)
unidades/mol (Constante de Avogadro)
Unidad de masa atómica (UMA)
u= UMA
Se da en UMA.
Cálculo de la masa atómica promedio.
Fórmula.
Ejemplo:
Número de Avogadro:
.gif) unidades/mol (Constante de Avogadro)
unidades/mol (Constante de Avogadro)
1 mol------ 6,02.1023 átomos
1 mol------ 6,02.1023 moléculas
Masa de 1 mol de moléculas= masa de
6,02.1023 moléculas.
Masa de 1 mol de moléculas= masa molecular molar= M (gr)
Masa de 1 mol de átomos= masa de 6,02.1023 átomos= A (gr)
Ar (masa atómica relativa) es el número que nos indica cuantas veces es mayor el átomo respecto al
13C; por eso no lleva unidades.
Publicado por
Romy Pech
en
17:39
2 comentarios:

Enviar por correo electrónicoEscribe un blogCompartir con TwitterCompartir con FacebookCompartir en Pinterest
Etiquetas:
Química Inorgánica
domingo, 24 de noviembre de 2013
Átomos. Estructura del átomo. Isótopos. Iones.
Átomo: es una partícula, la más pequeña, tiene características propias y es por naturaleza neutro. Se representa por símbolos.
Los átomos básicamente están formados por protones y neutrones que se encuentran distribuidos en el núcleo, y por electrones, los cuales se encuentran distribuidos en orbitales alrededor del núcleo.
Los protones, neutrones y electrones son las partículas atómicas fundamentales. Estas partículas poseen carga y masa.
La masa del electrón es despreciable. Una masa es despreciable con respecto a otra cuando la primera es más de 100 veces menor que la otra.
El tamaño del núcleo es muy pequeño respecto del átomo. Los orbitales ocupan 100.000 veces más espacio que el núcleo.
Representación del átomo.
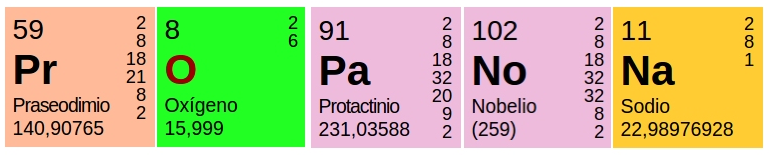
Se representan mediante símbolos, indicando el número de protones (n° atómico=Z) que se escribe en el lado inferior izquierdo del elemento y el número atómico (A=suma de protones y neutrones) ubicado en el lado superior izquierdo y determina el peso del elemento.
Ejemplos:
Número másico (A)= n° protones + n° neutrones
Los átomos básicamente están formados por protones y neutrones que se encuentran distribuidos en el núcleo, y por electrones, los cuales se encuentran distribuidos en orbitales alrededor del núcleo.
Los protones, neutrones y electrones son las partículas atómicas fundamentales. Estas partículas poseen carga y masa.
| Carga | Masa relativa (u) |
Masa (g) |
|
|---|---|---|---|
| Protones | + | aprox 1 |
|
| Neutrones | 0 | aprox 1 |
|
| Electrones | - | 1/1840 |
|
La masa del electrón es despreciable. Una masa es despreciable con respecto a otra cuando la primera es más de 100 veces menor que la otra.
El tamaño del núcleo es muy pequeño respecto del átomo. Los orbitales ocupan 100.000 veces más espacio que el núcleo.
Representación del átomo.
Se representan mediante símbolos, indicando el número de protones (n° atómico=Z) que se escribe en el lado inferior izquierdo del elemento y el número atómico (A=suma de protones y neutrones) ubicado en el lado superior izquierdo y determina el peso del elemento.
Isótopos.
Los isótopos son elementos iguales, con distinto número másico, esto es provocado porque los isótopos tienen distinto número de neutrones, provocando la diferencia en el número másico (A). El número de protones es el mismo, por lo tanto la identidad del átomo se mantiene.
Ejemplo:
Ion.
Los iones son átomos con carga eléctrica. Pueden ser cationes, si su carga eléctrica es positiva, o pueden ser aniones, si su carga eléctrica es negativa.
El elemento no cambia, porque no se modifica el número de protones. El núcleo es inalterable, sólo se modifica mediante radioactividad, pero si esto sucede, cambia el elemento.
En los iones lo que cambia es el número de electrones.
Ion bromuro:
Ion calcio (ion divalente o dipositivo):
Publicado por
Romy Pech
en
13:41
No hay comentarios:

Enviar por correo electrónicoEscribe un blogCompartir con TwitterCompartir con FacebookCompartir en Pinterest
Etiquetas:
Química Inorgánica
jueves, 12 de septiembre de 2013
Química. Curso Universitario. (Mahan. Myers) 4° Edición.
El link a este libro (y otros) lo encuentran en Instagram: @propanonablog (deben clickear en el link de la biografía y luego buscar la foto del libro. Al clickear la foto se descarga el archivo).
También pueden escribir un email a propanona@zoho.com y será enviado a la brevedad.
Publicado por
Romy Pech
en
21:55
12 comentarios:

Enviar por correo electrónicoEscribe un blogCompartir con TwitterCompartir con FacebookCompartir en Pinterest
Etiquetas:
Libros,
Química Inorgánica
sábado, 24 de agosto de 2013
Videos de las clases teóricas de Biología Celular y Molecular (año 2013)
Son los videos de este año que graba extensión. Están en formato flv.
Reproductor: VLC. Descarga para windows: http://www.videolan.org/vlc/download-windows.html
Codecs para windows: http://www.softonic.com/s/codec-flv-windows-media
Capítulo 2: Fundamentos químicos. (12-08-13)
1° parte: http://www.mediafire.com/download/oa5n92xfb8ooubp/Cap2.flv.part1.rar
2° parte: http://www.mediafire.com/download/f8zlz53lfsoxzf4/Cap2.flv.part2.rar
Capítulo 3: Estructura y función de las proteínas.
Parte 1 (14-08-13)
1° parte: http://www.mediafire.com/download/889mrf8nrxie28p/Cap3_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/mc2810eod7jcbcn/Cap3_parte1.flv.part2.rar
Parte 2 (16-08-13)
1° parte: http://www.mediafire.com/download/a6mpxxr857vw8zg/Cap3_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/0c96ht8o92yn0zk/Cap3_parte2.flv.part2.rar
Capítulo 5: Biomembranas y arquitectura celular.
Parte 1 (21-08-13)
1° parte: http://www.mediafire.com/download/k8c6wq09797d0b4/Cap5_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/iaa6xb78ivm7ddh/Cap5_parte1.flv.part2.rar
Parte 2 (23-08-13)
1° parte: http://www.mediafire.com/download/ppwbxdv0db2kabq/Cap5_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/4e8u070vbub87x7/Cap5_parte2.flv.part2.rar
3° parte: http://www.mediafire.com/download/9v7744tt0442wvo/Cap5_parte2.flv.part3.rar
Capítulo 4: Mecanismos genéticos moleculares básicos.
Parte 1 (26-08-13)
1° parte: http://www.mediafire.com/download/69jernbry8k1ql0/Cap4_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/if0p3x0f4wrki23/Cap4_parte1.flv.part2.rar
Parte 2 (28-08-13)
1° parte: http://www.mediafire.com/download/s14itn80c43hfmc/Cap4_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/a1y26z1tcx7e0d9/Cap4_parte2.flv.part2.rar
Capítulo 6: Integración de células en tejidos.
Parte 1 (30-08-13)
1° parte: http://www.mediafire.com/download/681icfw6xbxwwac/Cap6_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/3qmsju3k3ibhzzv/Cap6_parte1.flv.part2.rar
Parte 2 (02-09-13)
1° parte: http://www.mediafire.com/download/aecaza7dcnfz5th/Cap6_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/s45d29l544fi3ig/Cap6_parte2.flv.part2.rar
Capítulo 9: Técnicas de genética molecular y genómica.
Parte 1 (04-09-13)
1° parte: http://www.mediafire.com/download/dr8dbco7cv33ucx/Cap9_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/7p91w53m0s88doa/Cap9_parte1.flv.part2.rar
Parte 2 (06-09-13)
1° parte: http://www.mediafire.com/download/du847jzticw31nk/Cap9_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/f3lkqbel4o02cbk/Cap9_parte2.flv.part2.rar
Capítulo 10: Estructura molecular de genes y cromosomas.
Parte 1 (09-09-13)
1° parte: http://www.mediafire.com/download/3b9bw51oknxoptt/Cap10_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/k8d0co1bji9bfsb/Cap10_parte1.flv.part2.rar
3° parte: http://www.mediafire.com/download/8zseq5c5l125wk3/Cap10_parte1.flv.part3.rar
Parte 2 (11-09-13)
1° parte: http://www.mediafire.com/download/fe716r6ah7yhlo1/Cap10_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/er4xwema0kufljk/Cap10_parte2.flv.part2.rar
Capítulo 11: Control transcripcional de la expresión génica. (20-09-2013)
1° parte: http://www.mediafire.com/download/max05ptk1bf70dc/Cap11.flv.part1.rar
2° parte: http://www.mediafire.com/download/e3vlaw2ff52a4ey/Cap11.flv.part2.rar
3° parte: http://www.mediafire.com/download/h55gjyg752d695y/Cap11.flv.part3.rar
Capítulo 12: Control postranscripcional. (23-09-2013)
1° parte: http://www.mediafire.com/download/ykakpd1uc3yy8y5/Cap12.flv.part1.rar
2° parte: http://www.mediafire.com/download/ibu6uts6mfpt7u5/Cap12.flv.part2.rar
Capítulo 7: Transporte a través de membranas.
Parte 1 (25-09-2013)
1° parte: http://www.mediafire.com/download/jv7dzmvgzsc39rq/_Cap7_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/i2lojpz9dm14x8b/_Cap7_parte1.flv.part2.rar
Parte 2 (27-09-2013)
1° parte: http://www.mediafire.com/download/81zp9e5dbsk47do/Cap7_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/fkrkoc8wo1mlbqz/Cap7_parte2.flv.part2.rar
Capítulo 13: Señalización en la superficie celular.
Parte 1 (07-10-2013)
1° parte: http://www.mediafire.com/download/hd9qwppcq55f33i/Cap13_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/ndj5j60fc76749m/Cap13_parte1.flv.part2.rar
3° parte: http://www.mediafire.com/download/xwfi657uey8mvgf/Cap13_parte1.flv.part3.rar
Parte 2 (09-10-2013)
1° parte: http://www.mediafire.com/download/726z2d4lybsl3yi/Cap13_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/0yxt2ajcw83gvwa/Cap13_parte2.flv.part2.rar
Capítulo 14: Vías de señalización que controlan la actividad génica. (11-09-2013)
1° parte: http://www.mediafire.com/download/7z8bu40yeiypk7t/Cap_14.flv.part1.rar
2° parte: http://www.mediafire.com/download/66jn2bzz8dy2a1t/Cap_14.flv.part2.rar
3° parte: http://www.mediafire.com/download/icfqv8a9ycpfljy/Cap_14.flv.part3.rar
Capítulo 16: Movimiento de proteínas en las membranas y en los orgánulos.
Parte 1 (16-10-2013)
1° parte: http://www.mediafire.com/download/i9nu7bfx8nb4xmj/Cap_16_parte_1.flv.part1.rar
2° parte: http://www.mediafire.com/download/x0ucff4ngma7p9l/Cap_16_parte_1.flv.part2.rar
Parte 2 (18-10-2013)
1° parte: http://www.mediafire.com/download/w2dadkk2qo2oliw/Cap_16_parte_2.flv.part1.rar
2° parte: http://www.mediafire.com/download/6ag6xxplayyn54d/Cap_16_parte_2.flv.part2.rar
3° parte: http://www.mediafire.com/download/0kh90xnq97c2n0j/Cap_16_parte_2.flv.part3.rar
Capítulo 17: Tránsito vesicular, secreción y endocitosis.
Parte 1 (21-10-2013)
1° parte: http://www.mediafire.com/download/u8inae1o9ahzqgx/Cap_17_parte_1.flv.part1.rar
2° parte: http://www.mediafire.com/download/loqgovk5letoh1o/Cap_17_parte_1.flv.part2.rar
3° parte: http://www.mediafire.com/download/4n6bcke08winb8q/Cap_17_parte_1.flv.part3.rar
Parte 2 (23-10-2013)
1° parte: http://www.mediafire.com/download/85t09ivuve4p52o/Cap_17_parte_2.flv.part1.rar
2° parte: http://www.mediafire.com/download/7bscl9nfb449abc/Cap_17_parte_2.flv.part2.rar
Capítulo 19: Microfilamentos y filamentos intermedios.
Parte 1 (25-10-2013)
1° parte: http://www.mediafire.com/download/p1q0fceiiroea93/Cap19_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/l9b66n8f66wlsuz/Cap19_parte1.flv.part2.rar
Parte 2 (28-10-2013)
1° parte: http://www.mediafire.com/download/ttxda18239cja2b/Cap19_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/of2m617bf15aob7/Cap19_parte2.flv.part2.rar
Capítulo 20: Microtúbulos (30-10-2013)
Parte 1 (30-10-2013)
1° parte: http://www.mediafire.com/download/n5a7goef3zcl37s/Cap20.flv.part1.rar
2° parte: http://www.mediafire.com/download/t7i02s7h6d7k7au/Cap20.flv.part2.rar
Parte 2 (18-11-2013)
1° parte: http://www.mediafire.com/download/uw4bf5vne8v38sh/Cap20%20parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/tjrlu46mzptawnp/Cap20%20parte2.flv.part2.rar
Capítulo 21: Regulación del ciclo celular eucarionte.
Parte 1 (04-11-2013)
1° parte: http://www.mediafire.com/download/7jy2jr7tu7orwce/Cap21_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/1eg7f5bgf72c81p/Cap21_parte1.flv.part2.rar
Parte 2 (06-11-2013)
1° parte: http://www.mediafire.com/download/30d85jdlerlwltw/Cap21_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/3bd728afwm7i75u/Cap21_parte2.flv.part2.rar
Apoptosis
Parte 1 (08-11-2013)
1° parte: http://www.mediafire.com/download/ja5y47q2oof6tc5/Apoptosis_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/cngjcwg56pczjgv/Apoptosis_parte1.flv.part2.rar
Parte 2 (11-11-2013)
1° parte: http://www.mediafire.com/download/wlp3pud93y4xd4o/Apoptosis_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/uci8mnna4xedoa6/Apoptosis_parte2.flv.part2.rar
Especificación y diferenciación celular
Parte 1 (13-11-2013)
1° parte: http://www.mediafire.com/download/n01ku7an4kw33gj/Especificacion_y_diferenciacion_celular.flv.part1.rar
2° parte: http://www.mediafire.com/download/1j0i7bez6jsfzy0/Especificacion_y_diferenciacion_celular.flv.part2.rar
Parte 2 (15-11-2013)
http://www.mediafire.com/download/0kaem0fc2n7ldpr/Especificacion_y_diferenciacion_celular_parte2.flv
Capítulo 23. Cáncer.
Parte 1 (20-11-2013)
1° parte: http://www.mediafire.com/download/5x0816cxuwidgit/Cancer%20parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/xy3kadfjmdaqoas/Cancer%20parte1.flv.part2.rar
Parte 2 (22-11-2013)
1° parte: http://www.mediafire.com/download/ksq0p7rg60x9i3y/Cancer%20parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/y35zkcyu3bny5sr/Cancer%20parte2.flv.part2.rar
Reproductor: VLC. Descarga para windows: http://www.videolan.org/vlc/download-windows.html
Codecs para windows: http://www.softonic.com/s/codec-flv-windows-media
Capítulo 2: Fundamentos químicos. (12-08-13)
1° parte: http://www.mediafire.com/download/oa5n92xfb8ooubp/Cap2.flv.part1.rar
2° parte: http://www.mediafire.com/download/f8zlz53lfsoxzf4/Cap2.flv.part2.rar
Capítulo 3: Estructura y función de las proteínas.
Parte 1 (14-08-13)
1° parte: http://www.mediafire.com/download/889mrf8nrxie28p/Cap3_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/mc2810eod7jcbcn/Cap3_parte1.flv.part2.rar
Parte 2 (16-08-13)
1° parte: http://www.mediafire.com/download/a6mpxxr857vw8zg/Cap3_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/0c96ht8o92yn0zk/Cap3_parte2.flv.part2.rar
Capítulo 5: Biomembranas y arquitectura celular.
Parte 1 (21-08-13)
1° parte: http://www.mediafire.com/download/k8c6wq09797d0b4/Cap5_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/iaa6xb78ivm7ddh/Cap5_parte1.flv.part2.rar
Parte 2 (23-08-13)
1° parte: http://www.mediafire.com/download/ppwbxdv0db2kabq/Cap5_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/4e8u070vbub87x7/Cap5_parte2.flv.part2.rar
3° parte: http://www.mediafire.com/download/9v7744tt0442wvo/Cap5_parte2.flv.part3.rar
Capítulo 4: Mecanismos genéticos moleculares básicos.
Parte 1 (26-08-13)
1° parte: http://www.mediafire.com/download/69jernbry8k1ql0/Cap4_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/if0p3x0f4wrki23/Cap4_parte1.flv.part2.rar
Parte 2 (28-08-13)
1° parte: http://www.mediafire.com/download/s14itn80c43hfmc/Cap4_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/a1y26z1tcx7e0d9/Cap4_parte2.flv.part2.rar
Capítulo 6: Integración de células en tejidos.
Parte 1 (30-08-13)
1° parte: http://www.mediafire.com/download/681icfw6xbxwwac/Cap6_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/3qmsju3k3ibhzzv/Cap6_parte1.flv.part2.rar
Parte 2 (02-09-13)
1° parte: http://www.mediafire.com/download/aecaza7dcnfz5th/Cap6_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/s45d29l544fi3ig/Cap6_parte2.flv.part2.rar
Capítulo 9: Técnicas de genética molecular y genómica.
Parte 1 (04-09-13)
1° parte: http://www.mediafire.com/download/dr8dbco7cv33ucx/Cap9_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/7p91w53m0s88doa/Cap9_parte1.flv.part2.rar
Parte 2 (06-09-13)
1° parte: http://www.mediafire.com/download/du847jzticw31nk/Cap9_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/f3lkqbel4o02cbk/Cap9_parte2.flv.part2.rar
Capítulo 10: Estructura molecular de genes y cromosomas.
Parte 1 (09-09-13)
1° parte: http://www.mediafire.com/download/3b9bw51oknxoptt/Cap10_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/k8d0co1bji9bfsb/Cap10_parte1.flv.part2.rar
3° parte: http://www.mediafire.com/download/8zseq5c5l125wk3/Cap10_parte1.flv.part3.rar
Parte 2 (11-09-13)
1° parte: http://www.mediafire.com/download/fe716r6ah7yhlo1/Cap10_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/er4xwema0kufljk/Cap10_parte2.flv.part2.rar
Capítulo 11: Control transcripcional de la expresión génica. (20-09-2013)
1° parte: http://www.mediafire.com/download/max05ptk1bf70dc/Cap11.flv.part1.rar
2° parte: http://www.mediafire.com/download/e3vlaw2ff52a4ey/Cap11.flv.part2.rar
3° parte: http://www.mediafire.com/download/h55gjyg752d695y/Cap11.flv.part3.rar
Capítulo 12: Control postranscripcional. (23-09-2013)
1° parte: http://www.mediafire.com/download/ykakpd1uc3yy8y5/Cap12.flv.part1.rar
2° parte: http://www.mediafire.com/download/ibu6uts6mfpt7u5/Cap12.flv.part2.rar
Capítulo 7: Transporte a través de membranas.
Parte 1 (25-09-2013)
1° parte: http://www.mediafire.com/download/jv7dzmvgzsc39rq/_Cap7_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/i2lojpz9dm14x8b/_Cap7_parte1.flv.part2.rar
Parte 2 (27-09-2013)
1° parte: http://www.mediafire.com/download/81zp9e5dbsk47do/Cap7_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/fkrkoc8wo1mlbqz/Cap7_parte2.flv.part2.rar
Capítulo 13: Señalización en la superficie celular.
Parte 1 (07-10-2013)
1° parte: http://www.mediafire.com/download/hd9qwppcq55f33i/Cap13_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/ndj5j60fc76749m/Cap13_parte1.flv.part2.rar
3° parte: http://www.mediafire.com/download/xwfi657uey8mvgf/Cap13_parte1.flv.part3.rar
Parte 2 (09-10-2013)
1° parte: http://www.mediafire.com/download/726z2d4lybsl3yi/Cap13_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/0yxt2ajcw83gvwa/Cap13_parte2.flv.part2.rar
Capítulo 14: Vías de señalización que controlan la actividad génica. (11-09-2013)
1° parte: http://www.mediafire.com/download/7z8bu40yeiypk7t/Cap_14.flv.part1.rar
2° parte: http://www.mediafire.com/download/66jn2bzz8dy2a1t/Cap_14.flv.part2.rar
3° parte: http://www.mediafire.com/download/icfqv8a9ycpfljy/Cap_14.flv.part3.rar
Capítulo 16: Movimiento de proteínas en las membranas y en los orgánulos.
Parte 1 (16-10-2013)
1° parte: http://www.mediafire.com/download/i9nu7bfx8nb4xmj/Cap_16_parte_1.flv.part1.rar
2° parte: http://www.mediafire.com/download/x0ucff4ngma7p9l/Cap_16_parte_1.flv.part2.rar
Parte 2 (18-10-2013)
1° parte: http://www.mediafire.com/download/w2dadkk2qo2oliw/Cap_16_parte_2.flv.part1.rar
2° parte: http://www.mediafire.com/download/6ag6xxplayyn54d/Cap_16_parte_2.flv.part2.rar
3° parte: http://www.mediafire.com/download/0kh90xnq97c2n0j/Cap_16_parte_2.flv.part3.rar
Capítulo 17: Tránsito vesicular, secreción y endocitosis.
Parte 1 (21-10-2013)
1° parte: http://www.mediafire.com/download/u8inae1o9ahzqgx/Cap_17_parte_1.flv.part1.rar
2° parte: http://www.mediafire.com/download/loqgovk5letoh1o/Cap_17_parte_1.flv.part2.rar
3° parte: http://www.mediafire.com/download/4n6bcke08winb8q/Cap_17_parte_1.flv.part3.rar
Parte 2 (23-10-2013)
1° parte: http://www.mediafire.com/download/85t09ivuve4p52o/Cap_17_parte_2.flv.part1.rar
2° parte: http://www.mediafire.com/download/7bscl9nfb449abc/Cap_17_parte_2.flv.part2.rar
Capítulo 19: Microfilamentos y filamentos intermedios.
Parte 1 (25-10-2013)
1° parte: http://www.mediafire.com/download/p1q0fceiiroea93/Cap19_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/l9b66n8f66wlsuz/Cap19_parte1.flv.part2.rar
Parte 2 (28-10-2013)
1° parte: http://www.mediafire.com/download/ttxda18239cja2b/Cap19_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/of2m617bf15aob7/Cap19_parte2.flv.part2.rar
Capítulo 20: Microtúbulos (30-10-2013)
Parte 1 (30-10-2013)
1° parte: http://www.mediafire.com/download/n5a7goef3zcl37s/Cap20.flv.part1.rar
2° parte: http://www.mediafire.com/download/t7i02s7h6d7k7au/Cap20.flv.part2.rar
Parte 2 (18-11-2013)
1° parte: http://www.mediafire.com/download/uw4bf5vne8v38sh/Cap20%20parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/tjrlu46mzptawnp/Cap20%20parte2.flv.part2.rar
Capítulo 21: Regulación del ciclo celular eucarionte.
Parte 1 (04-11-2013)
1° parte: http://www.mediafire.com/download/7jy2jr7tu7orwce/Cap21_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/1eg7f5bgf72c81p/Cap21_parte1.flv.part2.rar
Parte 2 (06-11-2013)
1° parte: http://www.mediafire.com/download/30d85jdlerlwltw/Cap21_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/3bd728afwm7i75u/Cap21_parte2.flv.part2.rar
Apoptosis
Parte 1 (08-11-2013)
1° parte: http://www.mediafire.com/download/ja5y47q2oof6tc5/Apoptosis_parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/cngjcwg56pczjgv/Apoptosis_parte1.flv.part2.rar
Parte 2 (11-11-2013)
1° parte: http://www.mediafire.com/download/wlp3pud93y4xd4o/Apoptosis_parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/uci8mnna4xedoa6/Apoptosis_parte2.flv.part2.rar
Especificación y diferenciación celular
Parte 1 (13-11-2013)
1° parte: http://www.mediafire.com/download/n01ku7an4kw33gj/Especificacion_y_diferenciacion_celular.flv.part1.rar
2° parte: http://www.mediafire.com/download/1j0i7bez6jsfzy0/Especificacion_y_diferenciacion_celular.flv.part2.rar
Parte 2 (15-11-2013)
http://www.mediafire.com/download/0kaem0fc2n7ldpr/Especificacion_y_diferenciacion_celular_parte2.flv
Capítulo 23. Cáncer.
Parte 1 (20-11-2013)
1° parte: http://www.mediafire.com/download/5x0816cxuwidgit/Cancer%20parte1.flv.part1.rar
2° parte: http://www.mediafire.com/download/xy3kadfjmdaqoas/Cancer%20parte1.flv.part2.rar
Parte 2 (22-11-2013)
1° parte: http://www.mediafire.com/download/ksq0p7rg60x9i3y/Cancer%20parte2.flv.part1.rar
2° parte: http://www.mediafire.com/download/y35zkcyu3bny5sr/Cancer%20parte2.flv.part2.rar
domingo, 18 de agosto de 2013
sábado, 27 de julio de 2013
Cálculo del pI de un péptido.
Es una explicación práctica para calcular el pI de un péptido, espero que se entienda.
Dado el siguiente péptido: Ala-Glu-Gly-Lys
Lo importante es identificar los grupos -NH y -COOH terminales y si hay alguno en los aminoácidos no terminales, en este caso tenemos:
Lo cual podemos escribir de la siguiente manera:
Ahora debemos identificar los valores de pKa de cada uno de los grupos -NH2 y -COOH, los cuales se encuentran en la siguiente tabla:
En la primer columna tenemos los valores de pKa que corresponden al grupo -COOH unido al Cα, es decir, el -COOH terminal. En la segunda columna tenemos el pKa que corresponde al grupo -NH2 unido al Cα, es decir el -NH2 terminal. Y la tercer columna corresponde al grupo -NH2 o -COOH de la cadena lateral (según corresponda).
En nuestro ejemplo tenemos que:
Entonces, una vez identificados todos los valores de pKa los ordenamos de menor a mayor:
2,18
4,25
9,69
10,53
El pI de un péptido es el pH característico en el que la carga eléctrica del péptido es cero. Es un valor de pH, por lo tanto su valor estará comprendido entre 0 y 14.
El pI se calcula como pI=(pKa1 + pKa2)/2 donde los pKa son los pKa antes y después del pI.
Para esto hacemos una titulación de péptidos y vamos variando el valor de pH y analizando la carga neta de la molécula. Entonces empezamos por un valor de pH bajo, más bajo que el pKa más chico que tenemos (en nuestro ejemplo 2,18) entonces tomamos pH=1,00. A este valor de pH los grupos ionizables se encontrarán totalmente protonados:
A este pH la carga es +2.
Ahora elegimos un valor de pH que sea más alto que el pKa más bajo y más bajo que el valor de pKa que le sigue, o sea un pH que se encuentre entre 2,18 y 4,25, por ejemplo pH=3,00. A este pH se va a desprotonar el grupo de menor pKa, es decir que el grupo -COOH correspondiente al -COOH terminal (el del la Lys) se va a encontrar desprotonado:
En este caso la carga neta de la molécula es +1. Ahora repetimos el método: elegimos un valor de pH que se encuentre entre los dos pKa siguientes, es decir entre 4,25 y 9,69.
Siempre tenemos que tener: pH, pKa, pH, pKa... de menor a mayor, es decir de más ácido a más alcalino, donde tenemos a pH muy ácido todos los grupos ionizables protonados y a medida que vamos a pH más alcalino se van a ir desprotonando: se desprotona el grupo ionizable que tiene pKa menor que el pH), ahora tomamos pH= 7,00 y tenemos:
En este caso la carga neta de la molécula es 0, es decir que estamos en un valor cercano al valor de pI. El pH se encuentra entre pKa= 4,25 y pKa=9,69. Entonces en nuestra fórmula: pI=(pKa1+pKa2)/2 ya sabemos los dos valores de pKa que debemos reemplazar para calcular pI.
pI= (4,25+9,69)/2= 6,97
Dado el siguiente péptido: Ala-Glu-Gly-Lys
Lo importante es identificar los grupos -NH y -COOH terminales y si hay alguno en los aminoácidos no terminales, en este caso tenemos:
Lo cual podemos escribir de la siguiente manera:
Ahora debemos identificar los valores de pKa de cada uno de los grupos -NH2 y -COOH, los cuales se encuentran en la siguiente tabla:
En la primer columna tenemos los valores de pKa que corresponden al grupo -COOH unido al Cα, es decir, el -COOH terminal. En la segunda columna tenemos el pKa que corresponde al grupo -NH2 unido al Cα, es decir el -NH2 terminal. Y la tercer columna corresponde al grupo -NH2 o -COOH de la cadena lateral (según corresponda).
En nuestro ejemplo tenemos que:
Entonces, una vez identificados todos los valores de pKa los ordenamos de menor a mayor:
2,18
4,25
9,69
10,53
El pI de un péptido es el pH característico en el que la carga eléctrica del péptido es cero. Es un valor de pH, por lo tanto su valor estará comprendido entre 0 y 14.
El pI se calcula como pI=(pKa1 + pKa2)/2 donde los pKa son los pKa antes y después del pI.
Para esto hacemos una titulación de péptidos y vamos variando el valor de pH y analizando la carga neta de la molécula. Entonces empezamos por un valor de pH bajo, más bajo que el pKa más chico que tenemos (en nuestro ejemplo 2,18) entonces tomamos pH=1,00. A este valor de pH los grupos ionizables se encontrarán totalmente protonados:
A este pH la carga es +2.
Ahora elegimos un valor de pH que sea más alto que el pKa más bajo y más bajo que el valor de pKa que le sigue, o sea un pH que se encuentre entre 2,18 y 4,25, por ejemplo pH=3,00. A este pH se va a desprotonar el grupo de menor pKa, es decir que el grupo -COOH correspondiente al -COOH terminal (el del la Lys) se va a encontrar desprotonado:
En este caso la carga neta de la molécula es +1. Ahora repetimos el método: elegimos un valor de pH que se encuentre entre los dos pKa siguientes, es decir entre 4,25 y 9,69.
Siempre tenemos que tener: pH, pKa, pH, pKa... de menor a mayor, es decir de más ácido a más alcalino, donde tenemos a pH muy ácido todos los grupos ionizables protonados y a medida que vamos a pH más alcalino se van a ir desprotonando: se desprotona el grupo ionizable que tiene pKa menor que el pH), ahora tomamos pH= 7,00 y tenemos:
En este caso la carga neta de la molécula es 0, es decir que estamos en un valor cercano al valor de pI. El pH se encuentra entre pKa= 4,25 y pKa=9,69. Entonces en nuestra fórmula: pI=(pKa1+pKa2)/2 ya sabemos los dos valores de pKa que debemos reemplazar para calcular pI.
pI= (4,25+9,69)/2= 6,97
Publicado por
Romy Pech
en
14:39
32 comentarios:

Enviar por correo electrónicoEscribe un blogCompartir con TwitterCompartir con FacebookCompartir en Pinterest
Etiquetas:
Química Biológica
sábado, 30 de marzo de 2013
Clasificación de los aminoácidos.
Descargar: http://www.mediafire.com/view/?ak8z4m1g9l2ru8n
Es una tabla de aminoácidos (según el libro "Principios de Bioquímica de Lehninger") que tiene además el código de una letra y de tres.
Publicado por
Romy Pech
en
22:31
No hay comentarios:

Enviar por correo electrónicoEscribe un blogCompartir con TwitterCompartir con FacebookCompartir en Pinterest
Etiquetas:
Química Biológica,
Química Orgánica
sábado, 16 de marzo de 2013
Farmacobotánica. Unidad temática 3: Organografía.
Guía de TP: http://www.mediafire.com/view/?9oq1rf4jd4am552
Cuestionario de orientación: http://www.mediafire.com/download.php?vo368v1973jscj7
TP Nº1: Raíz. http://www.mediafire.com/view/?rcu61286eyv09pb
TP Nº2: Tallo. http://www.mediafire.com/view/?2ab1806ltiy0xx0
TP Nº3: Corteza y leño. http://www.mediafire.com/view/?7cmcl1wk4ikm6w8
TP Nº4: Hoja (I). http://www.mediafire.com/download.php?18epc110oh09t1w
TP Nº5: Hoja (II). http://www.mediafire.com/download.php?230hg97hgnpo9kg
Cuestionario de orientación: http://www.mediafire.com/download.php?vo368v1973jscj7
TP Nº1: Raíz. http://www.mediafire.com/view/?rcu61286eyv09pb
TP Nº2: Tallo. http://www.mediafire.com/view/?2ab1806ltiy0xx0
TP Nº3: Corteza y leño. http://www.mediafire.com/view/?7cmcl1wk4ikm6w8
TP Nº4: Hoja (I). http://www.mediafire.com/download.php?18epc110oh09t1w
TP Nº5: Hoja (II). http://www.mediafire.com/download.php?230hg97hgnpo9kg
Publicado por
Romy Pech
en
12:23
No hay comentarios:

Enviar por correo electrónicoEscribe un blogCompartir con TwitterCompartir con FacebookCompartir en Pinterest
Etiquetas:
Farmacobotánica
Farmacobotánica. Unidad temática 2: Técnicas de control para plantas medicinales.
Guía de Trabajos Prácticos: http://www.mediafire.com/view/?9oq1rf4jd4am552
Cuestionario de orientación: http://www.mediafire.com/view/?y7aa4zhoqx6qiw9
Cuestionario de orientación: http://www.mediafire.com/view/?y7aa4zhoqx6qiw9
Publicado por
Romy Pech
en
12:23
No hay comentarios:

Enviar por correo electrónicoEscribe un blogCompartir con TwitterCompartir con FacebookCompartir en Pinterest
Etiquetas:
Farmacobotánica
Farmacobotánica. Unidad temática 1: Célula y tejidos vegetales.
Guía de trabajos prácticos: http://www.mediafire.com/view/?9oq1rf4jd4am552
Respuestas al cuestionario: http://www.mediafire.com/view/?kzp9v8pv318dpr1
Imágenes de célula vegetal y animal: http://www.mediafire.com/view/?xlqdx2iiw8b8clt
Respuestas al cuestionario: http://www.mediafire.com/view/?kzp9v8pv318dpr1
Imágenes de célula vegetal y animal: http://www.mediafire.com/view/?xlqdx2iiw8b8clt
Publicado por
Romy Pech
en
12:23
No hay comentarios:

Enviar por correo electrónicoEscribe un blogCompartir con TwitterCompartir con FacebookCompartir en Pinterest
Etiquetas:
Farmacobotánica
Película: Camino al paraíso (Paradise Road)
Camino al paraíso.
Contraseña: propanona
Formato avi. Idioma: inglés. Subtitulos: español.
Publicado por
Romy Pech
en
11:06
5 comentarios:

Enviar por correo electrónicoEscribe un blogCompartir con TwitterCompartir con FacebookCompartir en Pinterest
Etiquetas:
Legislación Farmacéutica,
Películas
sábado, 12 de enero de 2013
2: Organización general de la célula.
"Todo lo que existe en el Universo es fruto del azar y de la necesidad"
Demócrito-Filósofo griego (siglo V aC)
Descarga: http://www.mediafire.com/view/?kkbln86naa4lrpc
Temario:
- El descubrimiento y el Estudio de la célula.
- Introducción.
- ¿Existe "la" unidad estructural y funcional para toda forma de vida?
- El microscopio y el estudio de las células.
- Microscopía óptica.
- ¿Cuáles son los diferentes tipos de microscopios ópticos? ¿Para qué se los utiliza?
- Microscopía electrónica.
- ¿Cómo se prepara una muestra o pieza para estudiarla al microscopio?
- Microscopía electrónica: técnicas..
- Métodos de cultivo en laboratorio.
- Fraccionamiento celular.
- Características generales de las células.
- ¿Qué características nos hacen pensar en la célula como la unidad de los seres vivos?
- Las células son sistemas complejos.
- Las células se reproducen.
- Las células metabolizan.
- Las células mantienen un equilibrio interno.
- Irritabilidad.
- Las células evolucionan.
- Mecanismos genéticos y bioquímicos básicos.
- El papel central del agua.
- Las biomoléculas.
- La energía y las células.
- Aspectos genéticos fundamentales.
- Las células procariontes.
- Composición química, tamaño y forma.
- Estructura de una célula procarionte.
- Rickettsias.
- Organización general de las célula eucariotas.
- Evolución de las células eucariotas.
- ¿Cómo se explica la presencia de mitocondrias y cloroplastos dentro de la célula eucariota?
- Células procariotas y eucariotas.
- ¿Qué ventajas proporcionan los compartimientos celulares?
- Compartimientos celulares.
- Compartimientos delimitados por doble membrana.
- Mitocondrias.
- Cloroplastos.
- Plástidos.
- El sistema de endomembranas.
- Retículo endoplasmático.
- Sistema de Golgi.
- Lisosomas.
- Microcuerpos.
- Virus y agentes sub-virales.
- ¿Qué es un virus?
- ¿Cómo es la estructura de los virus?
- Replicación viral.
- Etapas de la multiplicación viral.
- Infecciones virales.
- Los viroides: composición y estructura.
- Priones.
- Características del agente.
- Transmisión de los priones.
- Virusoides, virus satélites y ARNs satélite.
- La importancia del estudio de las células y los tejidos en patología.
domingo, 6 de enero de 2013
1: Visión General de los Fenómenos Biológicos
"Todo está relacionado. La diversidad de la vida en la Tierra está entretejida de manera intrincada, las partes se solapan, protegiendo su existencia entre sí. Los ecosistemas funcionan mejor cuando son complejos, a base de la participación de distintas plantas y animales donde cada cual ocupa su sitio, hace su vida y no necesariamente compiten."
ISAAC ASIMOV, Fronteras II.
- La biología y las ciencias de la salud.
- La biología y la medicina en la antigüedad.
- El nacimiento de la biología experimental.
- La biología en el siglo XX.
- Del conocimiento de los genes a la manipulación de ellos.
- Características de los seres vivos.
- Los seres vivos están formados por unidades llamadas células.
- Los seres vivos crecen y se desarrollan.
- Los componentes que forman a los seres vivos no son estáticos.
- Los seres vivos requieren materia para constituirse como tales.
- Los seres vivos requieren energía para desarrollar su actividad.
- Los seres vivos son obligatoriamente abiertos.
- Los seres vivos modifican el medio en que se encuentran.
- Los seres vivos responden a las señales del ambiente.
- Los seres vivos mantienen su medio interno relativamente constante a pesar de los cambios que ocurren en el exterior.
- Los seres vivos son capaces de perpetuarse a lo largo del tiempo dejando descendencia.
- Los seres vivos cambian a lo largo de las generaciones dando origen a nuevas especies.
- Los seres vivos están formados por el mismo tipo de materia que los elementos inertes.
- Otras consideraciones vinculadas a la organización de los seres vivos.
- ¿Vivos o no vivos?
- Los niveles de organización de la materia.
- El origen de la Tierra y su evolución química.
- El primer ser vivo y el comienzo de la evolución biológica.
- Distintos tipos de complejidad.
- Las células pueden formar colonias y también tejidos.
- En los pluricelulares los tejidos pueden formar órganos.
- Los órganos pueden formar sistemas de órganos.
- ¿Qué es un individuo?
- Los individuos constituyen poblaciones y la evolución actúa sobre ellas.
- Las poblaciones forman comunidades.
- Las comunidades forman ecosistemas.
- La diversidad de los seres vivos.
- La dinámica de la biodiversidad.
- ¿Por qué conservar la biodiversidad?
- Existen importantes razones sanitarias y económicas, más allá de cualquier argumento científico, que hacen que sea imprescindible conservar la biodiversidad.
- La clasificación de la biodiversidad.
- Distribución espacial de la biodiversidad.
- Biodiversidad y problemas sanitarios en la República Argentina.
Suscribirse a:
Entradas (Atom)





.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)


.gif)
.gif)





.gif)




.gif)
.gif)











